হুন্ডের নীতি
একই শক্তিসম্পন্ন বিভিন্ন অরবিটালে ইলেকট্রনগুলো এমনভাবে অবস্থান করবে যেন তারা সর্বাধিক সংখ্যায় অযুগ্ম বা বিজোড় অবস্থায় থাকতে পারে। এই সব অযুগ্ম ইলেকট্রনের স্পিন একইমুখী হবে। একই শক্তিসম্পন্ন বিভিন্ন অরবিটাল বলতে তিনটি p অরবিটাল, পাঁচটি d অরবিটাল ও সাতটি f অরবিটালকে বোঝানে হয়। s অরবিটালের জন্য হুন্ডের নিয়ম প্রযোজ্য নয়। হুন্ডের নীতি অনুযায়ী নিচে কিছু পরমাণুর ইলেকট্রন বিন্যাস দেওয়া হলোঃ
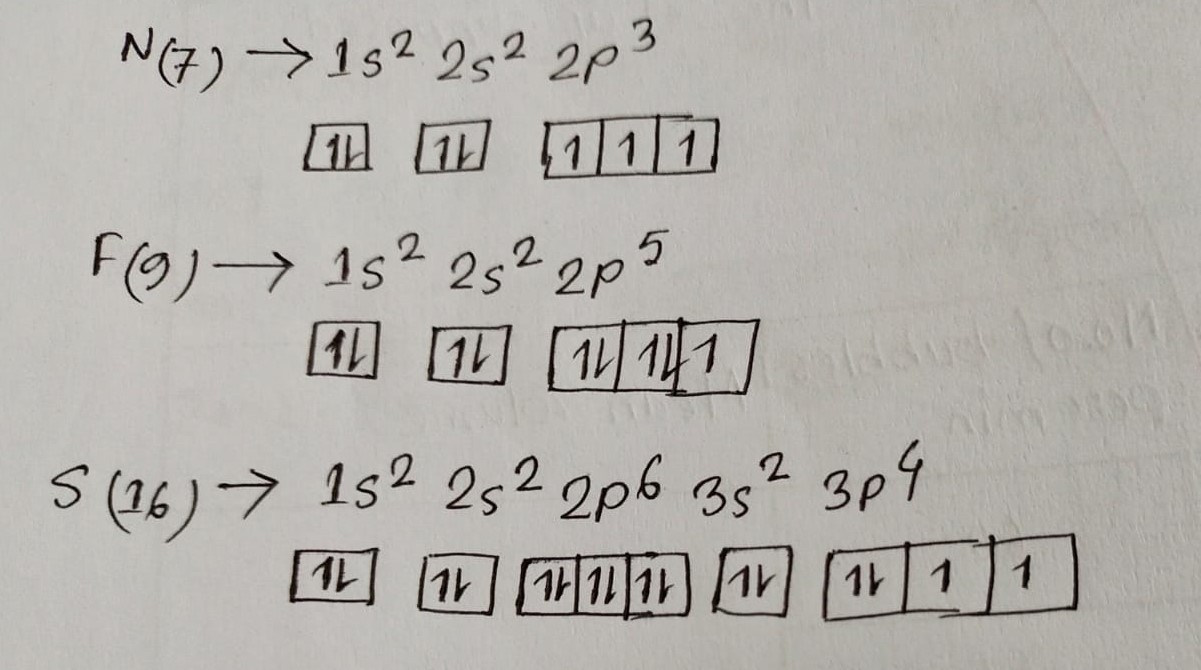
হুন্ডের নীতির ব্যাখ্যা
হুন্ডের নিয়মটির প্রয়োগ করে N(7) ও O (8) পরমাণুর ইলেকট্রন বিন্যাসে দেখানো হলো।
যেমন, নাইট্রোজেনের ইলেকট্রন বিন্যাস N (7) = 1s² 2s² 2p³। আবার 2p অরবিটালে প্রকৃতপক্ষে সমশক্তিসম্পন্ন তিনটি অরবিটাল আছে; এদেরকে Px, Py, Pz অরবিটাল হিসেবে চিহ্নিত করা হয়। সুতরাং নাইট্রোজেনের বেলায় উপরোক্ত 2p3 এর তিনটি ইলেকট্রন তিনটি সমশক্তির অরবিটালে আলাদাভাবে থাকবে এবং এদের স্পিনসমূহ একইমুখী হবে। যেমন,
N (7) = 1s2 2s2 2px2 2py¹ 2pz¹
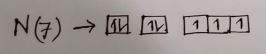
অনুরূপভাবে, অক্সিজেনের ইলেকট্রন বিন্যাস হবে,
O(8) = 1s² 2s² 2px1 2py1 2pz¹ কেননা 2p অরবিটালে ৪র্থ ইলেকট্রনটি একটি ইলেকট্রনের সাথে জোড়বদ্ধ অবস্থায় থাকবে।
নিচে হুন্ডের নীতি অনুসারে ইলেকট্রন বিন্যাসের স্পিন দেখানো হলো

# অর্ধপূর্ণ ও পরিপূর্ণ ইলেকট্রন যুক্ত বিন্যাস সম্পর্কিত ব্যাখ্যা
হুন্ডের নীতি অনুসারে অর্ধপূর্ণ ও পরিপূর্ণ ইলেকট্রন যুক্ত বিন্যাস অধিক স্থিতিশীল।
ব্যাখ্যা:
Cu এর ইলেকট্রন (e–) বিন্যাস সাধারণ নিয়মের ব্যতিক্রম ঘটে কেন?
Cu এর ইলেকট্রন বিন্যাস হলোঃ-
Cu(29) = 1s2 2s2 2p6 3s2 3p6 3d10 4s1
Cu এর ইলেকট্রন বিন্যাস সাধারণ নিয়মের ব্যতিক্রম ঘটে। কেননা এর সর্বশেষ শক্তিস্তরের 4s অর্বিটালের ১টি ইলেকট্রন 3d অর্বিটালে প্রবেশ করে।
“হুন্ডের নীতি অনুসারে অর্ধপূর্ণ ও পরিপূর্ণ ইলেকট্রন (e–) যুক্ত বিন্যাস অধিক স্থিতিশীল। তাই Cu এর 3d অর্বিটালের ইলেকট্রন (e–) ধারণ ক্ষমতা 10। যার পরিপূর্ণতা অর্জন করার জন্য ইলেকট্রন (e–) 4s এর আগে 3d তে প্রবেশ করে এবং সাধারণ ইলেকট্রন (e–) বিন্যাসের নিয়মের ব্যাতিক্রম ঘটে।
প্রশ্ন: কোনো একটি মৌলের যোজ্যতান্তরের ইলেকট্রনবিন্যাস হলো, ns2 np4 ; এখানে n=2। মৌলটির ক্ষেত্রে হুন্ডের নীতির প্রয়োগ হয়েছে কী না ব্যাখ্যা কর।
উত্তর :
হুন্ডের নীতি অনুসারে একই শক্তিসম্পন্ন বিভিন্ন অরবিটালে সর্বাধিক সংখ্যায় বিজোড় ইলেকট্রন থাকে।
উদ্দীপক অনুসারে মৌলটির যোজ্যতাস্তর বা সর্বশেষ শক্তিস্তরে ns² np4 ইলেকট্রন বিন্যাস বিদ্যমান। n=2 হলে মৌলটির যোজ্যতা স্তরের ইলেকট্রন বিন্যাস হয় 2s2 2p4 এবং মৌলটি হবে অক্সিজেন।অক্সিজেন এর ইলেকট্রন বিন্যাস নিম্নরূপ :
অক্সিজেন, O(8)→ 1s2 2s2 2p4
অরবিটাল পদ্ধতিতে ইলেকট্রন বিন্যাস হলো,
1s2 2s2 2px2 2py1 2pz1
এবং বক্স পদ্ধতিতে ইলেকট্রন বিন্যাস হলো,
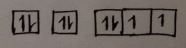
হুন্ডের নীতি অনুসারে ৩টি সমশক্তির p অরবিটালে সর্বশেষ চারটি ইলেকট্রন 2p4 সর্বাধিক বিজোড় অবস্থায় আছে। তই অক্সিজেন মৌলের ইলেকট্রন বিন্যাস হুন্ডের নীতি অনুসরণ করে বা মেনে চলে।
